-
Ваша корзина пуста!






В связи с изменениями требований к рыночной авторизации медицинской продукции на рынке Украины, изменились также и требования к маркировке упаковки медицинских изделий.
Информация на маркировке и в инструкции по применению медицинского изделия должна быть представлена на украинском языке согласно Закону Украины «Об основах государственной языковой политики», но дополнительно может включать и другие языки. Нанесение национального знака соответствия, указание наименования и адреса уполномоченного представителя производителя в Украине – важные нововведения по маркировке изделий, прошедших оценку соответствия. Описание знака соответствия утверждено ПКМУ № 1184 от 30.12.2015, вместе с тем, Технические регламенты уточняют требования к размерам знака. Если оценка соответствия проводилась с привлечением назначенного органа, то его номер необходимо указывается рядом со знаком.
Маркировка национальным знаком соответствия осуществляется, по решению производителя, на медицинское изделие или его упаковку, а также на инструкцию по применению медицинского изделия, если такая инструкция является обязательной. Указанная маркировка должна быть хорошо видимой, разборчивой и не должна стираться. Маркировка национальным знаком соответствия может наноситься на этикетку медицинского изделия. Если знак уменьшается или увеличивается, должны быть соблюдены соответствующие пропорции.
В связи с тем, что законодательные требования к маркировке упаковки медицинских изделий не консолидированы в каком-либо одном законодательном акте, сотрудники компании «Кратия» подробно изучили требования законодательных актов и подготовили свод требований к информации, языку и символам на упаковке медицинских изделий и инструкции по применению.
В штате нашей компании работают специалисты, которые готовы проверить существующую упаковку на соответствие требованиям законодательства, разработать стикер с учетом всех требований или локализировать макет упаковки согласно принятым стандартам.
Маркировка несет очень важную информацию для потребителя, которая, прежде всего, определяет все необходимые данные для безопасного и эффективного использования изделия. Верная, полная и точная маркировка чрезвычайно важна, поскольку:
Поэтому очень важно заранее разобраться, что такое «надлежащая маркировка» для медицинских изделий и когда наступает момент «введения в обращение» медицинского изделия; прояснить, что необходимо, а что только рекомендовано отображать на этикетке медицинского изделия.
Основная сложность заключается в том, что в настоящее время законодательство Украины не содержит единственного определения понятия «надлежащая маркировка» медицинских изделий.
В отличии от упаковки лекарственного средства, которая в ходе регистрации подлежит обязательному согласованию, процесс маркировки изделий медицинского назначения и медицинской техники остается на плечах производителя и его уполномоченного представителя, которые, безусловно, должны придерживаться отраслевых стандартов и требований законодательства в области технического регулирования.
Пример маркировки медицинского изделия с учетом требований ГСТУ EN 980:2007
На этапе проведения оценки соответствия медицинских изделий, во время предварительной экспертизы документации согласовываются не макеты маркировки, а только основные элементы.
Требования к маркировке медицинских изделий содержатся в целом ряде законов, постановлений КМУ и стандартов, среди которых есть как обязательные для использования, например, такие как:
так и добровольного использования, среди которых такие как:
Требования к маркировке, установленные обязательными нормами, подлежат безусловному выполнению, в то время как стандарты добровольного использования содержат требования рекомендательного характера, которые также становятся обязательными для конкретных изделий после декларирования производителем их соблюдения.
Важнейшие требования:
Важнейшим требованием является тождественность информации на маркировке изделия и информации в Декларации соответствия медицинского изделия. Постановлением КМУ 753 определено, что «ввоз на таможенную территорию, реализация и применение в Украине медицинских изделий разрешается только после прохождения процедуры оценки соответствия медицинских изделий Техническому Регламенту».
Во время нанесения маркировки продукции необходимо учитывать и придерживаться требований Закона Украины «О защите прав потребителей», в статье 15 которого указано право потребителя на информацию о продукции, а именно:
Информация о влиянии товара на здоровье человека не может быть отнесена к информации с ограниченным доступом. Существует строгое требование по предоставлению полной информации относительно рисков, нежелательных явлений и предостережений применения.
Указанная информация, с поправкой на применимость к конкретному медицинскому изделию, должна быть донесена потребителю на этикетке, в сопроводительной документации (инструкции, руководстве пользователя).
Информация на маркировке должна соответствовать законодательству о языках (языковой политике), которое определяет на сегодня украинский язык как единственный государственный и ряд языков как региональные. Согласно статьи 26 Закона Украины «Об основах государственной языковой политики», маркировка товаров, инструкции по их применению и тому подобное выполняются на государственном языке и региональном языке или языке меньшинства. По решению производителей товаров рядом с текстом, изложенным на государственном языке, может размещаться его перевод на другие языки.
Текст на маркировке, инструкции по применению (пособию потребителя) и других сопроводительных документах по применению медицинского изделия должны быть предоставлены на украинском языке.
Национальный стандарт ГСТУ EN 980:2007 «Символы графические для маркировки медицинских изделий» разработан с целью установления единых требований к маркировке как отечественных, так и зарубежных медицинских изделий (является тождественным переводом EN 980:2007 «Graphical symbol for use in the labeling of medical devices») и рекомендован к применению производителям. Стандарт определяет графические символы, которые чаще всего применяются производителями для предоставления информации относительно медицинских изделий и предназначенные для уменьшения потребности в многократном переводе слов на разные национальные языки.
Во время оценки соответствия медицинского изделия перед подачей пакета документации в орган по оценке соответствия согласовываются общие требования к маркировке путем утверждения образца упаковки. С введением в действие ГСТУ EN 980:2007, проводится экспертиза предоставленного образца маркировки на предмет его соответствия указанному стандарту, результатом которой является заверенный образец маркировки.
| Графический символ: | Его значение (согласно ДСТУ EN 980) и объяснение: |
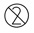 |
Повторно использовать ЗАПРЕЩЕНО |
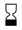 |
ИСПОЛЬЗОВАТЬ ДО — этот символ сопровождается датой, которая состоит из четырех цифр года, двух цифр месяца, и, при необходимости двух цифр дня. Дата должна быть прописана рядом с символом, или под ним, или справа от него. |
 |
КОД ПАРТИИ — этот символ сопровождается кодом партии производителя, который должен быть совмещенным с символом |
 |
РЕГИСТРАЦИОННЫЙ НОМЕР — этот символ сопровождается серийным номером изделия, который должен быть отмечен после или ниже символа |
 |
ДАТА ИЗГОТОВЛЕНИЯ — для активных имплантируемых медицинских изделий, символ будет совмещен с датой, отмеченной четырьмя цифрами года и двумя цифрами месяца. Для активных изделий символ должен сопровождаться годом.Дата должна быть отмечена после или ниже символа |
 |
СТЕРИЛЬНОСТЬ — лишь для медицинских изделий, которые полностью стерилизованы. Может быть применен с уточнением методов стерилизации |
 |
НОМЕР ПО КАТАЛОГУ — номер производителя по каталогу должен быть расположен после или ниже символа, смежного с ним |
 |
ПРЕДОСТЕРЕЖЕНИЕ! ОЗНАКОМИТЬСЯ С СОПРОВОДИТЕЛЬНЫМИ ДОКУМЕНТАМИ —также может быть синонимом символа «Внимание, смотри инструкцию по применению» |
 |
ПРЕДОСТЕРЕЖЕНИЕ! ОЗНАКОМИТЬСЯ С СОПРОВОДИТЕЛЬНЫМИ ДОКУМЕНТАМИ —также может быть синонимом символа «Внимание, смотри инструкцию по применению» |
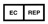 |
УПОЛНОМОЧЕННЫЙ ПРЕДСТАВИТЕЛЬ В ЕВРОПЕЙСКОМ СОЮЗЕ — этот символ должен сопровождаться названием и адресом уполномоченного представителя в Европейском Союзе |
 |
СОДЕРЖИТ ДОСТАТОЧНО ДЛЯ (n -) ИСПЫТАНИЙ |
 |
ЛИШЬ ДЛЯ ОЦЕНКИ РАБОТЫ МЕДИЦИНСКОГО ИЗДЕЛИЯ ДЛЯ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ IN VITRO |
 |
МЕДИЦИНСКОЕ ИЗДЕЛИЕ ДЛЯ ДИАГНОСТИКИ IN VITRO |
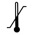 |
ТЕМПЕРАТУРНОЕ ОГРАНИЧЕНИЕ — Может быть применен лишь с верхним или нижним указанием температурного ограничения |
 |
ОЗНАКОМЛЕНИЕ С ИНСТРУКЦИЯМИ ДЛЯ ПРИМЕНЕНИЯ |
 |
БИОЛОГИЧЕСКИЕ РИСКИ |
Важно обратить внимание, что данный стандарт дополнен национальным обязательным дополнением, в котором приведены примеры применения символа «Уполномоченный представитель Производителя в Украине»:
Если во время технической экспертизы был утвержден образец маркировки с применением символов согласно ГСТУ EN 980:2007, то использование таких символов также становится обязательным.
Все указанные выше символы согласно стандарту EN 980 мы разработали в векторе, готовые к применению на макет упаковки медицинского изделия.
Законом Украины «Об охране прав на указание происхождения товаров» устанавливается требование по обязательному указанию географического места происхождения товара. Таким образом, страна происхождения, если она отличается от отмеченного на маркировке производителя, непременно должна присутствовать на маркировке упаковки продукции:
Следует обратить внимание на то, что термины «производитель» и «страна происхождения» не являются тождественными понятиями. Согласно Техническим регламентам, производитель — юридическое лицо или физическое лицо — предприниматель, которое отвечает за разработку, изготовление, упаковку и маркировку медицинского изделия перед вводом его в обращениепод собственным наименованием независимо от того, совершаются указанные действия таким лицом или иным лицом, уполномоченным действовать от его имени. Страна происхождения может определяться по принципу существенной переработки, или национальной доли в стоимости товара. Поэтому, разместить товар на рынке ЕС и указать себя производителем может, например, компания из Германии, а страной происхождения может быть Китай.
В нашей практике часто встречается, когда страна происхождения ошибочно отождествляется со страной производства, а сертификат соответствия в Украине содержит только конкретные названия, адреса и страны именно производителей.
Указание страны происхождения медицинского изделия является обязательным. А во время проведения оценки соответствия важно убедиться, что перечень производителей содержит не только предприятия, которые предоставили соответствующие документы и фигурируют на маркировке (с наименованиями компании и адресами), но и те, которые указаны в отмеченных странах происхождения на той же маркировке товара.
Другие аспекты маркировки медицинских изделий:
Маркировка продукции торговой маркой, которая зарегистрирована, регулируется Законом Украины «Об охране прав на знаки для товаров и услуг» предусматривает нанесение данного торгового знака на любой товар, для которого знак зарегистрирован, упаковку, в которой содержится такой товар, вывеску, связанную с ним, этикетку, нашивку, бирку или другой прикрепленный к товару предмет, хранение такого товара с указанным нанесением знака. Также упомянутый выше Закон определяет, что «владелец свидетельства имеет право проставлять рядом со знаком предупредительную маркировку, которая указывает на то, что этот знак зарегистрирован в Украине». При этом, регистрация торговой марки является добровольной и помогает защитить права на обозначение, включая торговое название и/или изображение.
Требования к размеру шрифта текстовой маркировки медицинского изделия также не регламентируются, и в основном зависит от ограниченности площади для нанесения этой информации и/или решения производителя или его представителя, дистрибьютора. Среди основных требований относительно нанесения информации в сопроводительной документации и/или на этикетке, а также на маркировке – это ее отражение в доступной наглядной форме. Следовательно, шрифт (размер и вид), форма представления информации должны быть доступными для восприятия (то есть при нормальном зрении информация должна быть воспринята без дополнительных усилий или устройств).
Право нанесения штрих-кода на товар имеет такую схему приоритетов: преимущественное право принадлежит владельцу торговой марки, потом — производителю, далее — поставщику. Следовательно, согласно Приказу № 255 от 20.08.2002 г. «Об утверждении Положения о
штриховой кодировки товаров» п. 5 не содержит ссылки на обязательное применение штрих-кода именно на медицинские изделия: «Обязательной маркировке штриховыми кодами GS1 подлежат алкогольные напитки и табачные изделия, экземпляры аудиовизуальных произведений и фонограмм, лекарственные средства и другие товары, маркировка которых штриховыми кодами предусмотрена законодательством Украины». Ни один специализированный нормативный документ не регламентирует обязательного применения штрих-кода, он может наноситься по желанию владельца, согласно вышеприведенному порядку удобным линейным или двухмерным способом.
Ответственность за предоставление надлежащей информации распределяется между производителем, уполномоченным представителем и продавцом. Законодательство не устанавливает, кто именно — производитель или продавец — несет ответственность, и потому этот вопрос требует определения в Договоре.
Также следует отметить, что стандарт EN 980:2007 в большинстве стран Европы утратил силу с 01.01.2013 и был заменен в 2012 году стандартом EN ISO 15223-1:2012. Новый стандарт не изменяет символы EN 980:2007, а вводит некоторые новые символы и обозначения.
Наша команда готова помочь Вам в проверке существующей и разработке новой маркировки упаковки на медицинские изделия и медицинскую технику, а именно: